近期,以广东药科大学生命科学与生物制药学院/广东省生物活性药物研究重点实验室为第一署名单位,卢雪梅副研究员为通讯作者的研究成果被中科院工程技术一区TOP期刊《Acta Biomaterialia》(IF: 10.633)正式录用并在线发表,该成果题为“Mitochondria-targeting folic acid-modified nanoplatform based on mesoporous carbon and a bioactive peptide for improved colorectal cancer treatment”,报道了一种口服结肠聚集性、线粒体靶向的药物递送系统(M27-39@FA-MCNs),该成果为课题组前期工作(2021年发表于中科院医学一区TOP期刊《Theranostics》,IF: 11.6)的延续。

口服结肠靶向递药系统(Oral colon-specific drug delivery systems, OCDDs)旨在将治疗药物靶向递送到结肠部位,以提高药物的有效性,增加生物利用度,减少全身副作用,有利于结直肠癌(Colorectal cancer, CRC)和炎症性肠病(Inflammatory bowel disease, IBD)等的精准治疗。然而,胃肠道复杂的生理环境变化会对OCDDs的药物靶向递送到患处产生重重阻碍,进而影响治疗效果,此外,生物相容性亦是靶向递药系统设计中需要考虑的先决前提。抗菌肽M27-39是课题组从家蝇Cecropin(Musca domestica Cecropin, MDC)筛选获得的小分子生物活性肽,不仅比家蝇抗菌肽MDC抗结肠癌活性更强,同时具有结构精简、易进入细胞、生产成本更低等优点。纳米介孔碳具有大孔容、高比表面积、载药率高、稳定性好、生物相容好、优异的结肠粘附性等特点,同时肿瘤组织高表达叶酸(FA)受体使得FA修饰的纳米介孔碳在药物靶向递送系统中展现出了巨大的潜能。在此项研究中,研究人员成功制备了一种口服结肠聚集性、线粒体靶向的药物递送系统(M27-39@FA-MCNs),实验结果显示M27-39@FA-MCNs能够靶向结直肠癌部位,提高M27-39蓄积与延长滞留时间,显著改善CRC小鼠症状,减少模型小鼠结直肠肿瘤数量和直径大小,减轻炎症反应,保护结肠结构完整,其抗CRC分子机制可能与M27-39@FA-MCNs可通过靶向线粒体,破坏线粒体能量代谢,调节线粒体凋亡信号通路和免疫炎症反应,诱导肿瘤细胞凋亡,从而增强其结直肠癌治疗效果相关。同时该系统在细胞毒性评估实验及小鼠毒理学评估实验中均显示出良好生物安全性。
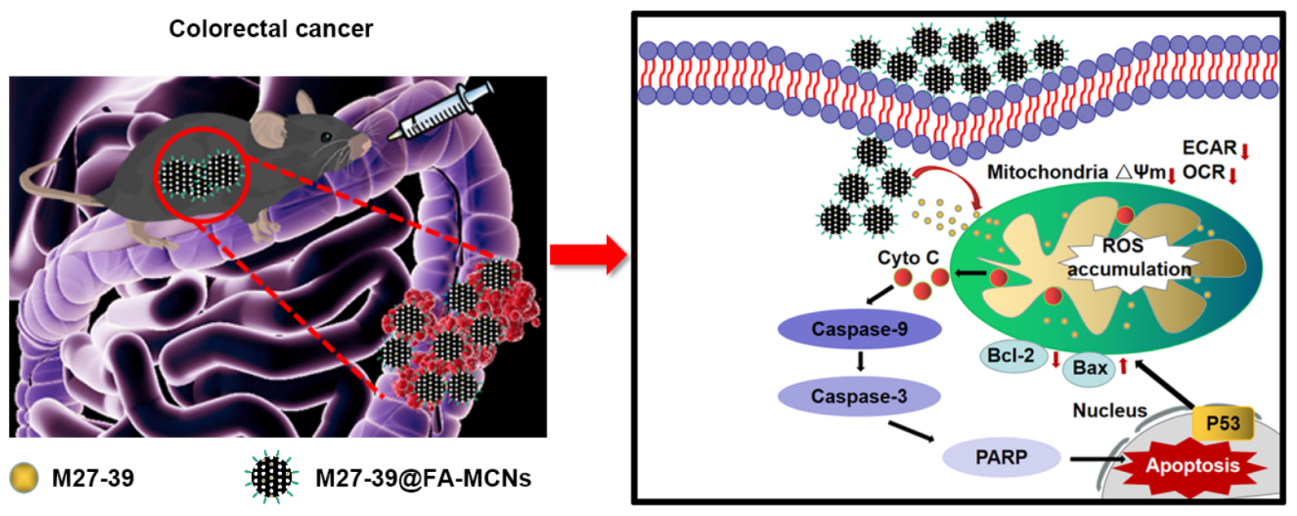
M27-39@FA-MCNs新型口服纳米递药系统靶向抗结直肠癌机制图
原文链接:https://doi.org/10.1016/j.actbio.2022.08.071
参考文献:
[1] Mitochondria-targeting folic acid-modified nanoplatform based on mesoporous carbon and a bioactive peptide for improved colorectal cancer treatment, Acta Biomaterialia, 2022. doi.org/10.1016/j.actbio.2022.08.071.